◆ ◆ ◆
声明:本文为新浪医药原创文章,转载需经授权,不尊重原创的行为新浪医药保留追责权利。
凭借可调节心血管疾病主要风险因子——LDL-C水平,PCSK9及其抑制剂自问世至今,颇受业内关注,被誉为是继他汀类药物之后降脂领域的重大进步。但由于当前上市药物治疗费用昂贵,患者治疗费用高达约14,500美元/年(且有学者计算,PCSK9抑制剂美国市场达300亿美元),成本效益比大大限制了其临床广泛应用。故疗效更好、价格更为合理、尤其是小分子化药,亟待开发。
当前,除已上市的2个PCSK9抑制剂外,国内药企如恒瑞医药、信达生物、君实生物等亦在布局该靶点,且有产品进入临床阶段,值得业内人士对其关注。
1PCSK9靶点简介
2003年,Abifadel等通过对两个患有常染色体显性遗传高胆固醇血症(ADH)的法国家族进行基因排查与分析后,首次报道了PCSK9基因突变也会引起ADH。
次年,研究人员对来自美国犹他州、挪威和英国的FH患者进行基因分析,结果表明:虽然PCSK9突变在人群中的发生率远低于LDLR 和 apoB,但是PCSK9某些氨基酸(D374)突变却能显著增加个体患CVD的风险。这一发现明确了PCSK9基因突变是继LDLR突变、apoB基因缺陷之后第三个FH的致病基因。
再后来,研究人员发现两个常见的PCSK9失功能型突变(PC-SK9-679X和 PCSK9-142X)与血中低LDL-C水平相关。该发现表明,PCSK9失功能型突变会促进肝对脂质的代谢,降低血中LDL-C水平。这提示PCSK9可以成为调节体内低密度脂蛋白代谢、降低心血管病发病率的重要药物靶点。
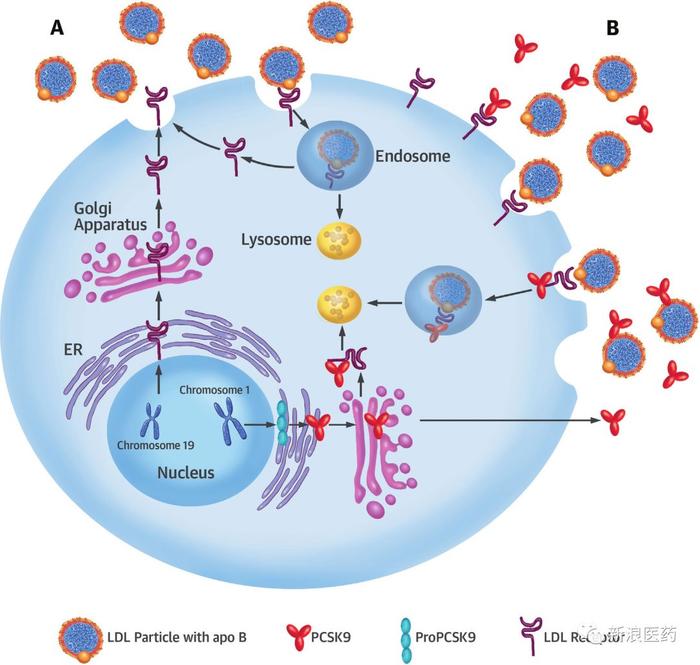
图1:PCSK9生命周期与LDL脂代谢的相关作用
2PCSK9抑制剂研发管线
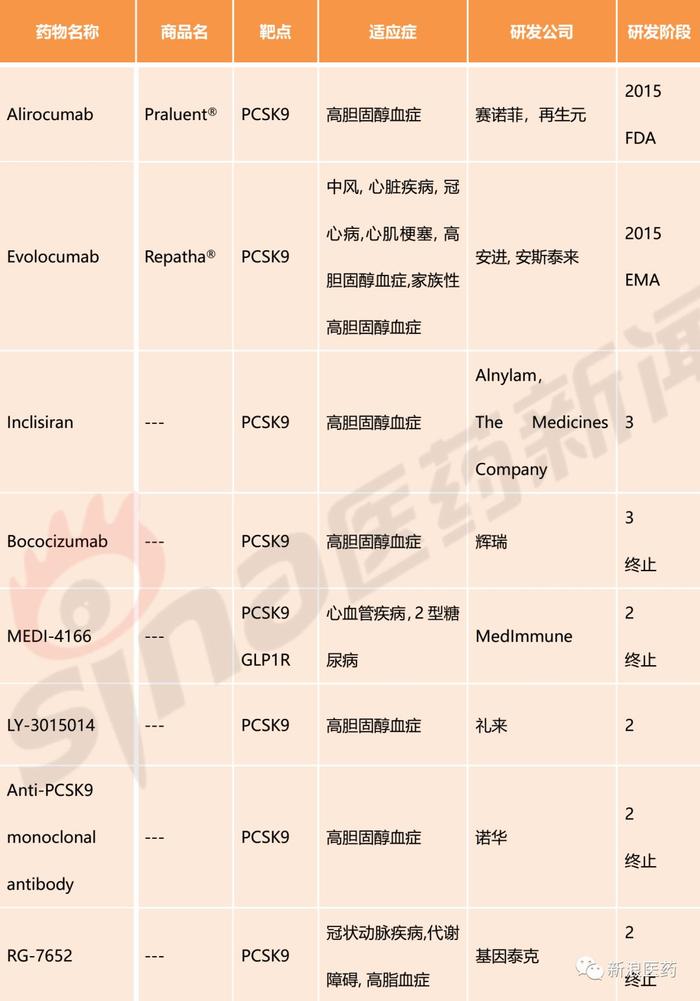
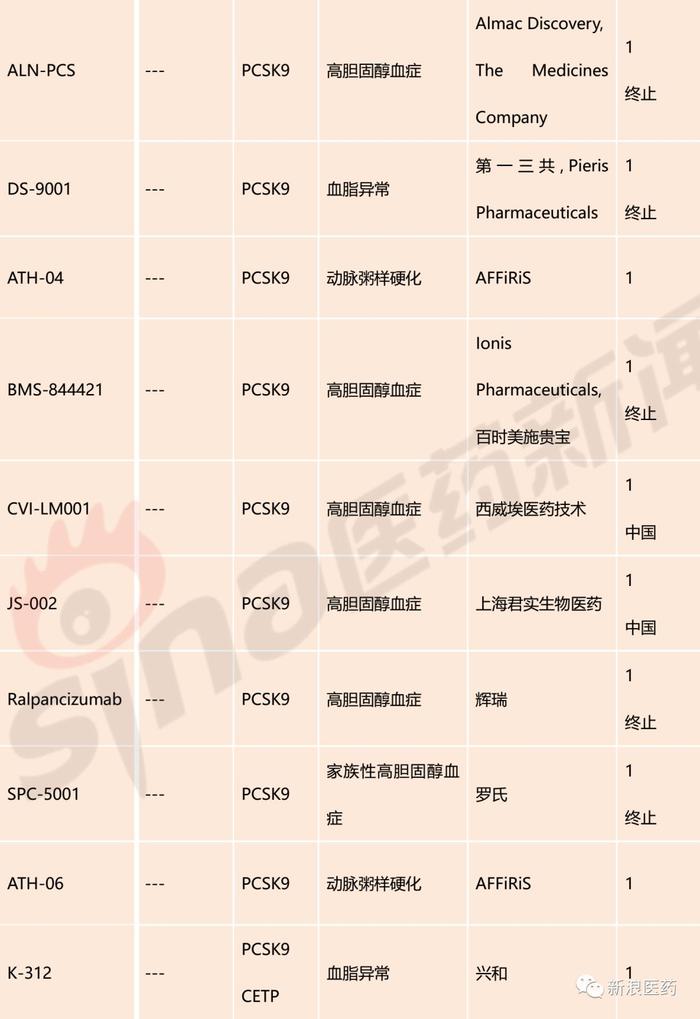
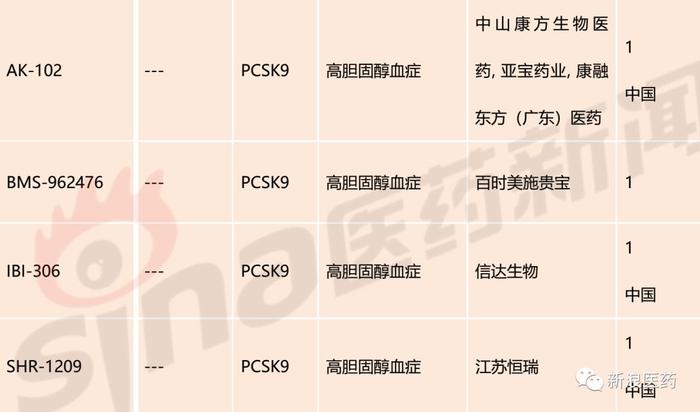
截至发稿,针对于PCSK9靶点已上市药物2个,分别为Alirocumab和Evolocumab,均为大分子生物药;处于临床III期的品种有2个,分别为辉瑞的Bococizumab和Alnylam/The Medicines Company的Inclisiran,其中辉瑞的Bococizumab已终止开发;临床II期品种有4个,临床I期品种有14个。国内已有部分企业对该靶点进行布局,亦有品种进入临床,分别为江苏恒瑞的SHR-1209、信达生物的IBI306、中山康方/亚宝/康融东方的AK102、君实生物的JS002和西威埃医药技术的CVI-LM001。
表1:PCSK9抑制剂主要研发管线
32个昂贵的已上市大分子生物药
Alirocumab
Alirocumab由赛诺菲和再生元联合研发,是一种全人源IgG1型单克隆抗体。Alirocumab 的 II 期临床试验对象为atorvastatin治疗无效患者,结果表明其主要不良反应为头痛头晕,腹泻,骨骼肌肉疼痛。此外,该抗体也在FH患者中显示出疗效,77个既往他汀治疗的FH患者,每两周给予150 mg Alirocumab 后,患者体内LDL的平均水平下降了90%,且没有发生肝转氨酶和肌酸激酶的升高,这一数据证明了该药可作为复发难治性高胆固醇血症有效的辅助治疗手段。III期临床ODYSSEY MONO 试验结果证明,在用药 24 周后,患者体内LDL-C 水平下降达 47 %,远高于Ezetimibe对照组。其注射区不良反应发生率小于4 %,且副反应相关肌肉症状在单抗组和其Ezetimibe对照组发生率相近。
该药于2015年7月获美国FDA批准,2015年9月获欧洲EMA批准,2016年7月获日本PMDA批准上市,用于治疗成人杂合子型家族性高胆甾醇血症和临床动脉粥样硬化心血管疾病(如需降低低密度胆固醇的心脏病或中风)。并由赛诺菲和再生元在美国、欧洲和日本市场共同销售,商品名为Praluent®。2015上市当年,该药的销售额近1千万美元;2016年,销售额为1.17亿美元;2017年,销售额为1.95亿美元。
表2:Alirocumab部分中国临床试验情况

Evolocumab
Evolocumab由安进开发,是一种全人源IgG2型单克隆抗体。Ⅰ、Ⅱ期临床试验主要招募纯合子家族遗传性高胆固醇血症患者和后天血胆固醇水平过高患者,临床试验结果证明,Evolocumab单独作用或者和 Ezetimibe联合用药,在降低血脂方面都有显著效果,最大 LDL-C水平下降幅度达48.8 %。而且Evolocumab未报道发生严重的药物不良反应。
该药于2015年7月获欧洲EMA批准,2015年8月获美国FDA批准,2016年1月获日本PMDA批准,用于治疗高胆固醇血症和混合血脂异常,并降低成人心血管疾病患者心肌梗死、中风和冠状动脉血运重建的风险。安进在美国和欧洲市场销售,安斯泰来在日本市场销售,商品名为Repatha®。2015上市当年,该药的全球销售额1千万美元;2016年,销售额为1.41亿美元;2017年,销售额为3.29亿美元。
表3:Evolocumab部分中国临床试验情况

4国内药企5大品种
SHR-1209
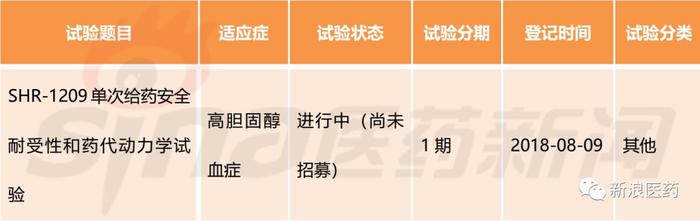
SHR-1209,大分子生物药,由江苏恒瑞及其全资公司苏州盛迪亚生物医药联合向中国CFDA药品审评中心递交了新药临床试验申请(治疗用生物制品1类),2018年3月获得受理,于2018年7月获得临床批件。
表4:SHR-1209部分中国临床试验情况
IBI-306
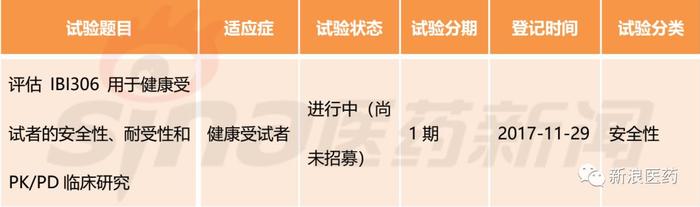
IBI-306,大分子生物药,由信达生物开发,2017年2月由CDE承办,目前处于临床I期研究阶段,用于治疗高胆固醇血症。
表5:IBI-306部分中国临床试验情况
JS-002
JS-002,大分子生物药,由君实生物开发,2016年8月由CDE承办,2017年7月获得临床批件,目前处于临床I期研究阶段。
表6:JS-002部分中国临床试验情况

CVI-LM001
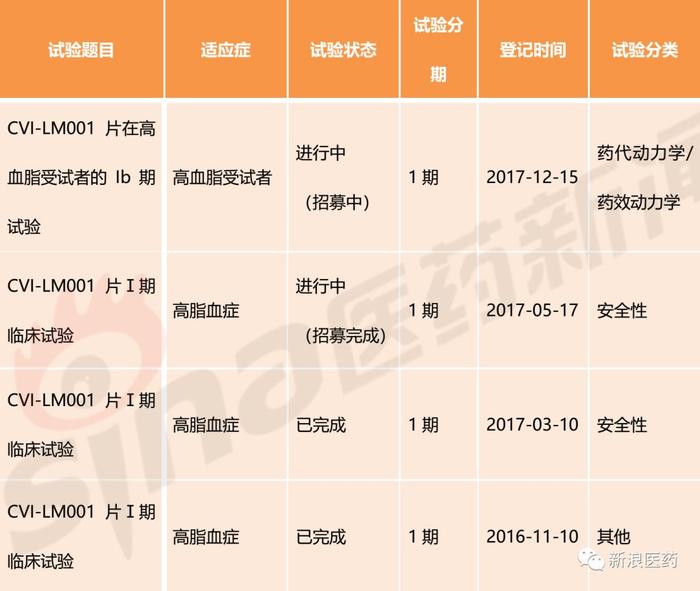
CVI-LM001,小分子化药,由西威埃医药技术研发,2014年6月申报中国化药1.1类临床研究,2016年3月获得临床批件,目前在中国处于临床I期,用于治疗高脂血症。
表7:CVI-LM001部分中国临床试验情况
AK-102
AK-102,大分子生物药,该药最初由苏州亚宝与中山康方共同合作研发,于正式启动临床前开发时,由中山康方购回所有权益,现由康融东方(广东)医药(中山康方与东瑞制药成立的投资公司)进行后续研发和申报;当前,CDE已于2017年5月获得受理,2018年4月获得临床批件,并开始治疗高脂血症的临床I期试验。
表8:AK-102部分中国临床试验情况

5 小 结
从药物靶点来说,PCSK9的发现与开发大跨步补强了当前降脂药市场药品阵容。从候选药物开发状态来说,大分子探路、小分子跟进的策略,也在循序实施当中。价格方面,虽然当前价格超级昂贵,但为了最大的收益获取,原研企业必定会在价格方面下功夫,毕竟所针对疾病及群体特点不同于抗癌药。国内方面,已有5个品种进入临床,虽处于I期,但都是相对比较靠谱的制药公司在做,值得期待。
参考:
1. PCSK9 inhibitors in clinical practice: Delivering on the promise? 2018
2. PCSK9 Inhibitors Economics and Policy. 2017
3. The cost-effectiveness of PCSK9 inhibitors - The Australian healthcare perspective. 2017
4. PCSK9 inhibitors in clinical practice: Expectations and reality. 2018
5. The Evolving Future of PCSK9 Inhibitors. 2018
6. CNKI
发布于:北京




举报成功