导读:
核苷酸结合寡聚化结构域、富含亮氨酸重复序列的结构域以及含有蛋白1的Pyrin结构域炎症小体(Nlrp1)、Caspase-1(Casp1)和Caspase-6(Casp6)的连续激活与原代人类的神经元培养和阿尔茨海默病(AD)等神经退行性病变密切相关。近期,《Cell Death & Differentiation》(IF=10.717)期刊上发表了题为“Therapeutic potential of Nlrp1 inflammasome, Caspase-1, or Caspase-6 against Alzheimer disease cognitive impairment”的论文,作者在Nlrp1、Casp1或Casp6缺失的遗传学背景上构建了APPSwedish/Indiana J20 AD转基因小鼠模型,并通过一系列实验证明了Nlrp1、Casp1及Casp6与AD的认知障碍、炎症和淀粉样蛋白生成密切相关,该研究表明Nlrp1、Casp1和Casp6是AD认知障碍和炎症的潜在治疗靶点。

背景
目前对于阿尔兹海默病(AD)的治疗虽然有帮助,但效果仍十分有限。因此,我们需要找寻针对AD病理的替代治疗方法。早期AD认知功能下降和神经元功能障碍的潜在分子机制将是一个理想的治疗靶点。
在AD脑和人CNS原代神经元培养物中发现了一种将神经元内核苷酸结合寡聚化结构域、富含亮氨酸重复序列和含有蛋白1(Nlrp1)炎症小体和半胱天冬酶-1(Casp1)介导的神经炎症与半胱天冬酶-6(Casp6)介导的轴突变性联系起来的退行性通路。活性Casp6在散发性和家族性AD脑神经炎斑块、神经纤维缠结和神经纤维网线中大量存在。它出现在内嗅皮层和海马Cornu Ammonis 1(CA1)与非认知功能障碍的老年个体的情景记忆和语义记忆表现下降相关。在小鼠海马CA1区锥体神经元中条件性表达人自激活的Casp6可诱导与炎症和神经退行性变相关的可逆性年龄依赖性认知障碍,不存在斑块和缠结。在人CNS原代神经元培养物和细胞系中,活性Casp6裂解淀粉样前体蛋白(APP)、Tau和几种AD相关的突触和细胞骨架神经元蛋白,caspases间接增加Aβ水平。活性Casp6本身不会诱导细胞死亡,但会导致原代人皮层a nd nG F剥夺的小鼠感觉神经元轴突变性。活化的Casp6微注射诱导CA1区神经元突触传递丢失和变性,活化的Casp6表达诱导CA1区神经元突触传递丢失和变性。
在人CNS原代神经元培养基中,Casp6被Casp1激活。Casp1与认知功能下降和AD有关。活性Casp1触发促炎性白细胞介素-1β(IL-1β)的成熟。AD中活性Casp1和IL-1增加。IL-1与胶质细胞增生、记忆障碍、促炎细胞因子生成和白细胞浸润相关。Casp1基因变异与较低的IL-1β水平、较好的执行功能表现和较好的记忆功能趋势相关,并可预测从MCI到AD的加速进展。在J20 APP AD小鼠中,当分别在症状前或症状发作时给予Casp1抑制剂VX-765可延迟或逆转认知障碍。此外,Casp1消融可预防J20和APP/PS1小鼠的记忆障碍。Casp1在人类神经元中被功能性Nlrp1炎症小体激活。Nlrp1免疫阳性神经元在AD大脑中增加25-30倍,Nlrp1与活性Casp6共定位。非同义Nlrp1 SNP与AD相关。在小鼠中基因消融Nlrp1和Casp1可阻止LPS诱导的Casp6活化。
转基因小鼠模型的记忆评估
旷场分析评估了每个队列接受记忆测试的能力。与WT小鼠相比,4-5月龄J20小鼠在行进距离、象限进入、时间移动的百分率或趋向性方面未表现出显著差异(图1A和补充S2A–C)。J20/Nlrp1−/−或 J20/Nlrp1+/−和J20/Casp1−/−小鼠比WT小鼠表现出略高的行进距离和象限进入,尽管它们的%时间移动和在外周是正常的。J20/Casp6-/-或J20/Casp6 +/-和WT/Nlrp1−/−或WT/Nlrp1 +/−,/Casp1−/−或 /Casp1+/−,/Casp6−/−或 /Casp6+/−小鼠在4项指标中均表现正常。这些结果表明,所有14个小鼠组都有能力进行记忆测试。
Nlrp1、Casp1及Casp6基因消融预防J20小鼠情景记忆和空间记忆缺陷
与WT小鼠相比,J20小鼠的非辨别指数(DI)较低,证实4-5月龄J20小鼠的情景记忆受损(图1B,补充表S1),如前所述。J20/Nlrp1−/−或 J20/Nlrp1+/−、J20/Casp1−/−或 J20/Casp1+/−和J20/Casp6−/−或 J20/Casp6+/−小鼠DI标准化为WT水平。基因消融的WT小鼠的情景记忆没有改变。这些结果证实了Nlrp1、Casp1和Casp6在APPSw/Ind-介导的情景记忆缺陷中的重要性,并表明将基因表达减少一半足以消除损伤。
用Barnes迷宫评估4~5月龄J20小鼠空间学习记忆保持能力。在评估学习的四天训练期间,J20,而不是J20/Nlrp1−/−或J20/Nlrp1 +/−,J20/Casp1−/−或 J20/Casp1+/−,J 20/Casp6−/−或 J 20/Casp6+/−,在训练期结束时比WT小鼠犯更多的错误到达目标(图1C,补充表S1)。任何基因型达到目标的潜伏期没有差异(图1C)。在测量空间记忆保持的探针测试期间,J20小鼠倾向于犯更多的错误(p = 0.065),但由于反应的较大变异性,这无统计学显著性(图1D)。J20缺乏显著的空间记忆缺陷可能是由于其年龄较小,因为5-7个月的J20明确显示空间记忆缺。尽管如此,J20/Casp1−/−和J20/Casp6−/−小鼠比J20小鼠犯的错误更少。所有基因型均未改变探针潜伏期。与WT小鼠相比,J20对目标区域表现出不太明显的偏好;它们对每个孔的戳百分比分散在相邻区域之间,在目标处产生一个较小的峰值(补充图1)。在J20/Nlrp1−/−或J20/Nlrp1 +/−,J20/Casp1−/−或 J20/Casp1+/−,J 20/Casp6−/−或 J 20/Casp6+/−小鼠中标准化。所有WT小鼠组均表现正常。这些结果表明Casp1或Casp6基因消融使J20小鼠的空间记忆正常化。J20/Nlrp1−/−或J20/Nlrp1 +/−,J20/Casp1−/−或 J20/Casp1+/−,J20/Casp6−/−或 J20/Casp6+/−小鼠也能改善学习记忆保持,尽管它们并没有完全达到正常水平。
Nlrp1、Casp1或Casp6的基因消融可使J20海马CA1树突棘、CA3和DG突触蛋白水平正常化
用高尔基体-Cox染色评估海马CA1区放射层(SR)树突棘密度和形态(补充图S4A).与野生型相比,J20的树突棘密度(图1E)和蘑菇百分比(图1F),而不是薄或粗短(图1G,H),脊柱亚型显著减少。与WT相比,J20/Nlrp1−/−、J20/Casp1−/−和J20/Casp6−/−小鼠的脊柱密度和形态标准化。所有基因型CA1区锥体细胞层(PCL)细胞密度相同(补充图S4B),表明J20小鼠树突棘改变与神经元丢失无关。
同时测定海马突触前突触蛋白免疫染色密度(补充图S4C).与野生型相比,J20齿状回(DG)(图1I)和CA3(图1J)的突触蛋白水平降低,但CA1(图1K)没有降低。DG和CA3区nlrp1、Casp1和casp6的基因消融使J20突触蛋白水平恢复到WT水平。这些结果表明,Nlrp1、Casp1和casp6参与了J20介导的树突棘突触破坏和突触蛋白水平。
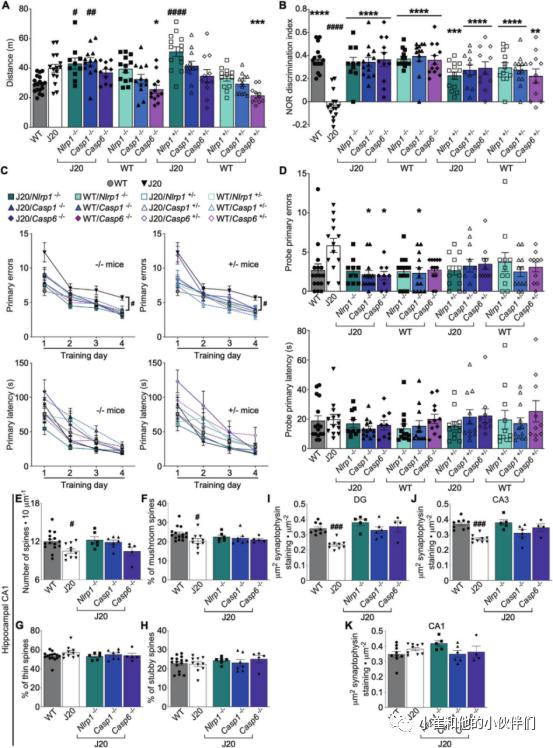 图1 Nlrp1、Casp1或Casp6基因消融可预防J20小鼠的认知缺陷
图1 Nlrp1、Casp1或Casp6基因消融可预防J20小鼠的认知缺陷J20小鼠中Nlrp1、Casp1或Casp6基因消融抑制了电离钙结合适配器分子1(Iba1)+-小胶质细胞的密度
在海马(Fig.2A)和皮层(SupplementaryS5).Iba1 +小胶质细胞在J20中的丰度是WT海马和皮层的两倍(图2B,C和补充表S2)。与J20相比,J20/Casp1−/−或 J20/Casp1+/−和J20/Casp6−/−海马和皮质小胶质细胞减少,并标准化到WT水平,而J20/Casp6 +/−Iba1 + 小胶质细胞数量低于J20但仍高于WT水平。J20/Nlrp1−/−或 J20/Nlrp1+/−海马小胶质细胞低于J20但高于WT小鼠,而皮质Iba1 +小胶质细胞数量与J20小鼠保持相似。所有基因消融的WT组海马和皮质Iba1 +小胶质细胞数量相似,除了WT/Casp6 +/-的皮质小胶质细胞增加。这些结果表明Nlrp1,Casp1和Casp6明显参与APPSw/Ind-介导的海马Iba1 +小胶质细胞增加,尽管J20/Nlrp1−/−或J20/Nlrp1 +/−和J20/Casp6 +/−Iba1 +小胶质细胞水平没有正常化。相反,虽然Casp1和Casp6参与皮质小胶质细胞的增加,但Nlrp1则不参与。提示另一种炎症小体可能更多地参与皮质。
基因消融不会改变J20小鼠胶质纤维酸性蛋白免疫阳性(GFAP +)星形胶质细胞
GFAP + 染色密度(补S6A)在J20海马中比皮层高约6倍但在WT和J20小鼠之间没有显著差异(补S6B、C和补充表S2)。完全或部分Nlrp1,Casp1或Casp6消融没有改变J20或WT小鼠的GFAP+染色。说明Nlrp1、Casp1、Casp6不参与J20介导的星形胶质细胞增生。
 图2 在J20小鼠中,Nlrp1、Casp1或Casp6基因消融可减少激活的小胶质细胞,但不能减少星形胶质细胞
图2 在J20小鼠中,Nlrp1、Casp1或Casp6基因消融可减少激活的小胶质细胞,但不能减少星形胶质细胞Nlrp1,Casp1,o rcasp6基因消融使C-X-C基序趋化因子配体1(CXCL1)正常化并增加干扰素γ(IFN-γ)水平,其中nlrp1orcasp1基因消融使J20海马肿瘤坏死因子α(TNF-α)正常化
在WT、J20、J20/Nlrp1−/−、J20/Casp1−/−和J20/Casp6−/−中定量细胞因子生成。在海马中(图3A–J),任何组之间的总IL-1β均无差异(图3A)。与野生型小鼠相比,J20小鼠的TNF-α(Fig.3B)和CXCL1(图3C)增加。完全消融Nlrp1和Casp1,而不是Casp6,使TNF-α正常化(图3B),其中Nlrp1、Casp1和Casp6消融使CXCL1水平正常化(图3 C)。IFN-γ在所有基因消融的J20海马中均增加,但在WT和J20小鼠之间无差异(图3D)。海马IL-2、IL-4、IL-5、IL6、IL-10或IL12p70未检测到变化(图3E–J)。在皮质中(图3K–T),与WT和J20相比,除J20/Nlrp1−/−中IL-2(图3O)和IL-6(图3R)增加外,任何组之间均未发现任何细胞因子的差异。说明TNF-α和CXCL1促炎细胞因子可能与APPSw/Ind-介导的认知障碍和小胶质细胞活化有关。此外,IFN-γ增加可能有助于APPSw/Ind-介导的认知功能下降和小胶质细胞活化中Nlrp1、Casp1和Casp6基因消融的有益作用。
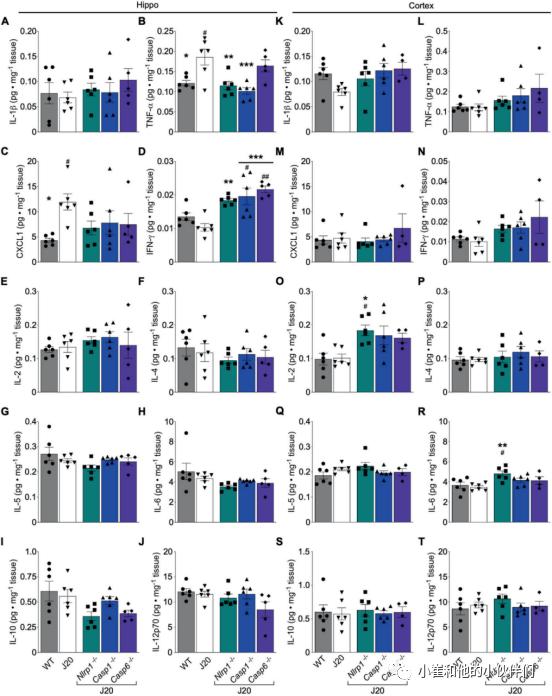 图3 Nlrp1、Casp1、Casp6基因消融改变J20海马促炎细胞因子水平
图3 Nlrp1、Casp1、Casp6基因消融改变J20海马促炎细胞因子水平Nlrp1,Casp1或Casp6基因消融不会改变J20小鼠的APP水平
相对于野生型,J20中人APP mRNA(图4A)和蛋白(图4B–D)水平增加,但在J20/Nlrp1,/Casp1,或/Casp6−/−或 +/−大脑中保持不变。APPαC-末端片段(CTF)(图4B,E)和β-CTF(图4B,F)在任何J20基因型之间没有差异,除了J20/Nlrp1 +/-中α-CTF增加(图4E)。总之,这些结果排除了α-o rβ分泌酶改变APP表达或加工解释Nlrp1,Casp1或Casp6基因消融对J20认知障碍和小胶质细胞激活有益作用的可能性。
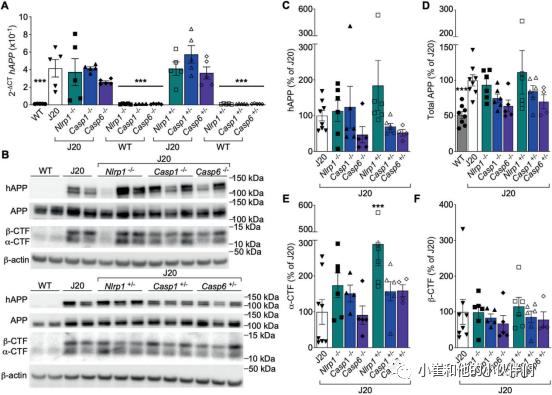 图4 Nlrp1,Casp1或Casp6基因消融不会改变J20皮层的APP水平
图4 Nlrp1,Casp1或Casp6基因消融不会改变J20皮层的APP水平Nlrp1,Casp1或Casp6基因消融使J20小鼠海马Aβ水平降低50%
4-5月龄J20,和部分或完全Nlrp1-、Casp1-和Casp6-消融的J20大脑中Aβ沉积,呈弥漫性,主要集中在海马腔隙分子层(SLM)和DG(图5A,补充S7A).皮质脾后及初级、次级运动区存在罕见的Aβ沉积(补S7B).与J20小鼠相比,部分或完全Nlrp1-、Casp1-或Casp6-消融的J20小鼠J20海马中Aβ沉积物的丰度约为皮质的2倍,海马中Aβ沉积物的丰度低50%,但在皮质中相当(图5B和补充表S3)。一致地,J20小鼠Nlrp1,Casp1,或Casp6消融后海马甲酸可溶性总Aβ、Aβ38、Aβ40和Aβ42水平下降50%以上(图5C,补充S7 C和补充表S3)。在J20/Nlrp1−/−和J20/Casp1 +/−小鼠中也观察到甲酸可溶性Aβ38、Aβ40和Aβ42亚种相对于总Aβ比值的显著变化:Aβ40/总Aβ升高,但Aβ38和Aβ42比值降低(图5C)。J20/Nlrp1-/-小鼠海马RIPA可溶性总Aβ、Aβ38、Aβ40和Aβ42水平下降~50%(图5D,补充S7D),但在所有其他基因消融的J20小鼠中没有改变。
皮质中甲酸可溶性总Aβ水平远低于海马(图5E)。Nlrp1、Casp1和Casp6的完全或部分消融并没有改变甲酸或RIPA-可溶性(图5F,补充S7F)J20皮质中Aβ38、Aβ40和Aβ42水平或其与总Aβ的比值。这些结果表明Nlrp1、Casp1和Casp6有助于J20海马聚集的Aβ沉积。
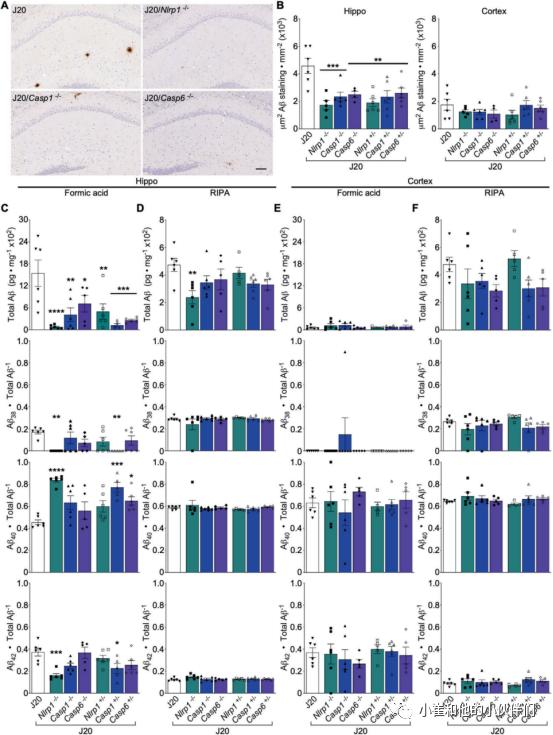 图5 Nlrp1,Casp1或Casp6基因消融可防止J20小鼠淀粉样蛋白沉积
图5 Nlrp1,Casp1或Casp6基因消融可防止J20小鼠淀粉样蛋白沉积Iba1 +小胶质细胞与情景记忆相关,IFNγ和CXCL1与J20小鼠的空间记忆相关
进行多变量线性回归以确定哪种海马变量最能预测J20小鼠的情景记忆和空间记忆缺陷(表1)。对从多聚甲醛固定或冷冻的大脑获得的数据进行分析。多聚甲醛固定海马突触蛋白、Iba1+小胶质细胞和Aβ免疫染色的测量显示,只有Iba1+小胶质细胞密度与NOR辨别指数评分相关(表1)。冷冻大脑中的海马生化标志物(包括脊柱密度、促炎性TNFα、IFNγ和CXCL1细胞因子以及总甲酸可溶性Aβ蛋白水平)均与NOR评分无关。从多聚甲醛固定的组织中获得的突触蛋白、Iba1+小胶质细胞密度或Aβ水平均与Barnes迷宫探针主要错误无关(表1)。从冷冻的大脑数据来看,只有IFNγ和CXCL1水平与Barnes迷宫空间记忆相关。总之,这些结果表明Iba1+小胶质细胞预测J20的情节,而IFNγ和CXCL1预测空间记忆表现。
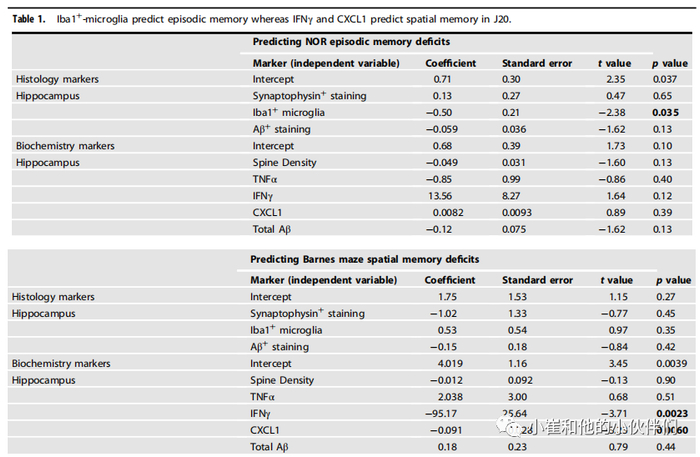
表1 在J20中,Iba1+小胶质细胞预测情景记忆,而IFN-γ和CXCL1预测空间记忆
Casp1,而非Nlrp1或Casp6保护J20小鼠免于过早死亡
只有40-50%的J20小鼠在5月龄时存活,尽管被饲养在无病原体的设施中(图6A)。Nlrp1或Casp6的基因消融没有改变J20的存活率,但Casp1的基因消融提高到接近100%(图6B,C)。任何基因消融均不影响WT小鼠的存活率(图6D,E)。这些结果表明Casp1,而不是Nlrp1或Casp6参与J20增加死亡率。
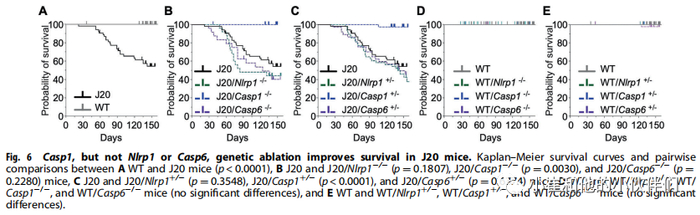 图6 Casp1,而不是Nlrp1或Casp6,基因消融可提高J20小鼠的存活率
图6 Casp1,而不是Nlrp1或Casp6,基因消融可提高J20小鼠的存活率讨论
这些数据表明,Nlrp1、Casp1和Casp6参与认知通过相同的途径发生。先前在血清剥夺的人神经元、LPS注射的WT/Nlrp1−/−和WT/Casp1−/−小鼠大脑中发现了Nlrp1、Casp1和Casp6的顺序激活。在这项研究中,所有三个基因的基因消融几乎相同地纠正了J20介导的情景记忆和空间记忆缺陷、CA1树突棘密度丢失以及CA3和DG突触蛋白免疫反应性降低。因为APPSw/Indis在神经元特异性启动子下表达,小胶质细胞中Casp6缺失或非常低,作者的结果表明nlrp1-casp1casp6神经退行性通路导致J20小鼠脑神经元变性(图7)。因此,所有三个基因的基因消融可以缓解J20小鼠的认知障碍。部分和完全Nlrp1,Casp1或Casp6消融使不溶性Aβ减少50%与应激神经元产生Aβ增加一致。Aβ在16月龄APP/PS1小鼠小胶质细胞中诱导Nlrp3炎症小体。在这里,Aβ不可能激活小胶质细胞,因为所有三个基因的基因消融降低Aβ水平的程度相同,但只有Casp1和Casp6,而不是Nlrp1,基因消融完全使Iba1+小胶质细胞水平正常化。此外,4-5个月大的J20小鼠还没有积累显著水平的Aβ。作者提出4-5个月大的J20 Iba1 + 小胶质细胞是由Nlrp1-Casp1-Casp6通路引起的神经元变性的结果,而不是由Aβ激活小胶质细胞,因为神经变性总是与胶质细胞活化相关,Casp1和Casp6基因消融完全使Iba1 + 小胶质细胞正常化。Nlrp1消融对Iba1 +小胶质细胞水平的部分影响表明,神经元APPSw/Indexpression可以激活另一个炎症小体,导致Casp1和Casp6介导的神经退行性变。目前,尚不清楚TNF-α和CXCL1水平的升高是否源于神经元或小胶质细胞。CXCL1水平通过NLRP1、Casp1、Casp6基因消融正常化,提示CXCL1的神经元起源。
进行了多变量线性回归分析,试图确定哪些指标与J20小鼠的认知功能相关。海马Iba1+小胶质细胞是唯一与情景记忆表现显著相关的指标,而IFNγ和CXCL1与空间记忆表现相关。这些结果表明每种记忆类型的特定通路。这些关联是认知的致病因蛋白还是辅助因蛋白仍有待证实,但它们在认知中的作用得到了其他研究的支持。Iba1+小胶质细胞与J20小鼠的情景记忆呈负相关,在VX-765处理的J20小鼠中随着认知功能的恢复而降低。在唐氏综合征小鼠模型中,小胶质细胞耗竭或抗炎药物治疗降低了Iba1+小胶质细胞,并恢复正常的NOR表现和脊柱密度。同样,在这里,Nlrp1、Casp1和Casp6的缺失恢复了认知、脊柱密度、突触蛋白水平和Iba1+ 小胶质细胞水平。在J20中,海马IFN-γ随着Nlrp1、Casp1和Casp6基因消融而升高,表明可能有助于缓解认知缺陷。一致地,IFN-γ可改善5xFAD和APP/PS1小鼠的认知。在所有基因消融的J20中,J20中海马CXCL1的增加是正常化的。CXCL1是中性粒细胞的强效化学引诱物。有趣的是,中性粒细胞可阻止APP/PS1、5xFAD和CRND8 AD小鼠模型的小毛细血管中的血流,导致记忆受损。通过清除血管中中性粒细胞的抗Ly6G治疗可迅速逆转记忆缺陷。
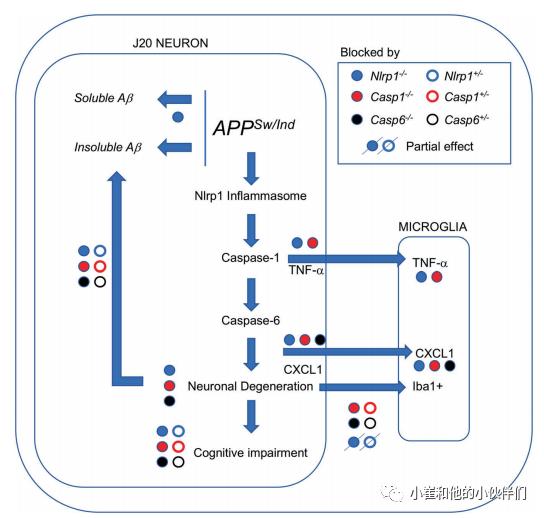 图7 J20介导的神经退行性变和认知障碍的LRP1、Casp1和CASP6基因消融结果示意图
图7 J20介导的神经退行性变和认知障碍的LRP1、Casp1和CASP6基因消融结果示意图小结
Nlrp1、Casp1或Casp6抑制剂是治疗MCI和AD认知障碍的可行方法。罕见的自然发生的CASP1或CASP6变异,分别具有非常低的CASP1活性或没有CASP6催化活性,这都与人类病理无关。在正常成人大脑中很难检测到Casp6的表达。总之,这些结果强调了Nlrp1、Casp1和Casp6在AD认知缺陷中的重要性。由于这些蛋白在AD大脑中的表达都发生了改变,Nlrp1、Casp1和Casp6代表了预防或治疗AD认知障碍的三个潜在的治疗靶点。
精读论文请下载原文:
Flores J, Noël A, Fillion ML, LeBlanc AC. Therapeutic potential of Nlrp1 inflammasome, Caspase-1, or Caspase-6 against Alzheimer disease cognitive impairment. Cell Death Differ. 2021 Oct 8. doi: 10.1038/s41418-021-00881-1.
发布于:陕西




举报成功